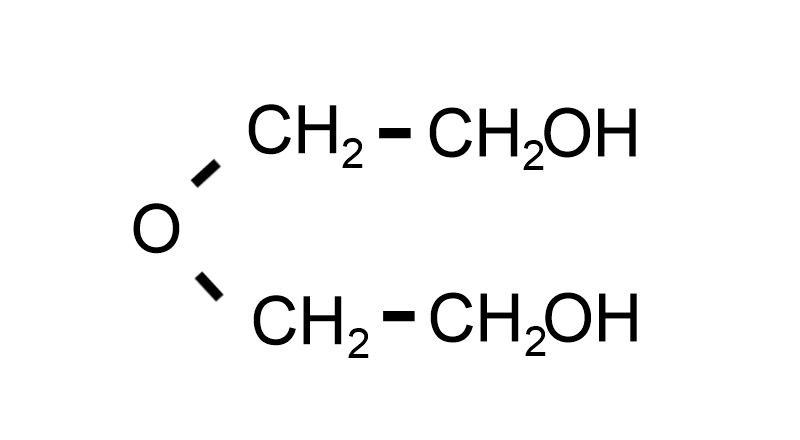Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Токсикология, экотоксикология
Токсичность самого диэтиленгликоля следует отличать от синергической токсичности продукта, связанного с другим токсичным продуктом или продуктом, который будет иметь токсический эффект, связанный только с этим растворителем (как и все растворители, диэтиленгликоль может способствовать абсорбции других продуктов посредством организмов или их попадание в орган-мишень, который в противном случае был бы свободен от них. На сегодняшний день лишь несколько исследований были посвящены синергизму.
Для одного диэтилен-гликола: пероральная доза без воздействия составляет согласно INRS (в 2008 г.) 180 мг · кг -1 · сут -1 (для крыс). Следует отметить, что определенные воздействия (помимо репротоксичности ) наблюдаются только у самцов крыс, а не у самок, что может указывать на нарушение эндокринной системы, но это явление не наблюдалось у кроликов или мышей.
Кинетика продукта в организме
Вдыхание : плохо изученный процесс у человека. У крыс этот продукт, по-видимому, имеет незначительную активность через воздух.
Проглатывание : После проглатывания диэтиленгликоль всасывается в основном из желудочно-кишечного тракта . Он быстро проникает в кровь ( период полураспада в крови : 3,6 ч) и концентрируется в печени и почках , затем в головном мозге (легко проникает через гематоэнцефалический барьер , при этом пиковая концентрация в головном мозге наблюдается через 3-4 часа после этого. прием внутрь, при этом высокая доза вызывает наркотический эффект ), в мышцах и жировой ткани .
Метаболизация : у лабораторных крыс 14-41% дозы метаболизируется до (2-гидроксиэтокси) уксусной кислоты (2-HEAA). У крыс все еще кажется, что он не превращается в этиленгликоль , но следы щавелевой кислоты, иногда обнаруживаемые в моче, могут быть связаны с осмотическим диурезом, вызванным гигроскопической природойэтого продукта.
Синергетические действия вероятны при наличии коктейлей загрязнителей, но не изучены.
Острая токсичность
У животных ЛД 50 при пероральном введении: от 13,3 до 26,5 у крыс и мышей, от 7,8 до 14 г у морских свинок, 9 г · кг -1 у собак и 3 г у кошек. Симптомы, общие для всех видов млекопитающих: наркоз, отказ от еды, жажда , затем в высоких дозах: одышка , прострация, кома ( уремическая кома , вызванная повышенным диурезом с последующей олигурией и анурией ), гипотермия с фазой и смертью от 2 до 7 дней. после администрации. Удивительно, но воздействие через воздух (8 часов в атмосфере, насыщенной этиленгликолем) не убило крыс и не оказало раздражающего воздействия на кожу или глаза.
У людей данные отсутствуют, но наблюдаемые симптомы (с точки зрения острой токсичности) такие же, как у животных. В 1996 году на Гаити более 60 детей умерли от острой почечной недостаточности после употребления сиропа от кашля, содержащего глицерин, загрязненный диэтиленгликолем.
Хроническая токсичность и низкие дозы
Хроническая токсичность диэтиленгликоля изучалась на крысах: (с 4% продукта в пище ( 2400 мг · кг -1 · сут -1 ) в течение 2 лет мы наблюдаем:
- медленный рост молодых крыс;
- гематотоксичность, связанная с повреждением почек (атрофия канальцев, гиалиновые цилиндры, кристаллические конкременты в канальцах, лимфоцитарная инфильтрация и начало фиброза);
- поражения печени: центрилобулярная или диффузная атрофия, разрастание желчных протоков, жировая дистрофия. У 30% самцов крыс также появляются камни в мочевом пузыре, состоящие на 75% из фосфатов, кристаллизованных на ядре оксалата кальция . (не наблюдается у кроликов или собак, экспериментально экспонированных в лаборатории).
Канцерогенность
Что касается воздействия одного продукта, оно, вероятно, является редким, непрямым и обусловленным воздействием высоких доз, но экспериментально продемонстрировано на крысах. У 1,7% крыс, получавших пероральную дозу 4% диэтиленгликоля с пищей в течение 2 лет, развился рак мочевого пузыря, вероятно, вызванный образующимися там камнями; это будет фактор «инородного тела», который вызвал бы опухоль, а не сам продукт.
Токсичность продуктов распада
При высоких температурах он распадается на окись или двуокись углерода, альдегиды и кетоны. Продукты биоразложения и / или их метаболиты в почве или гумусе, по-видимому, не изучались.
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
Использует
Как и в случае с этиленгликолем , смесь воды и диэтиленгликоля может использоваться в качестве антифриза . Температура плавления смеси понижена, что делает ее привлекательной для использования в холодном климате.
Кроме того, поскольку температура кипения этого продукта выше, чем у этиленгликоля, эта смесь также более интересна в жарком климате.
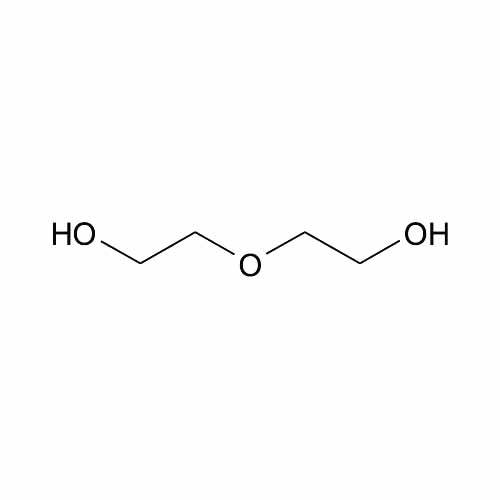
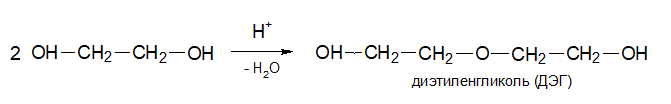
Диэтиленгликоль используется, например, для химического синтеза;
- из морфолина
- из 1,4-диоксана .
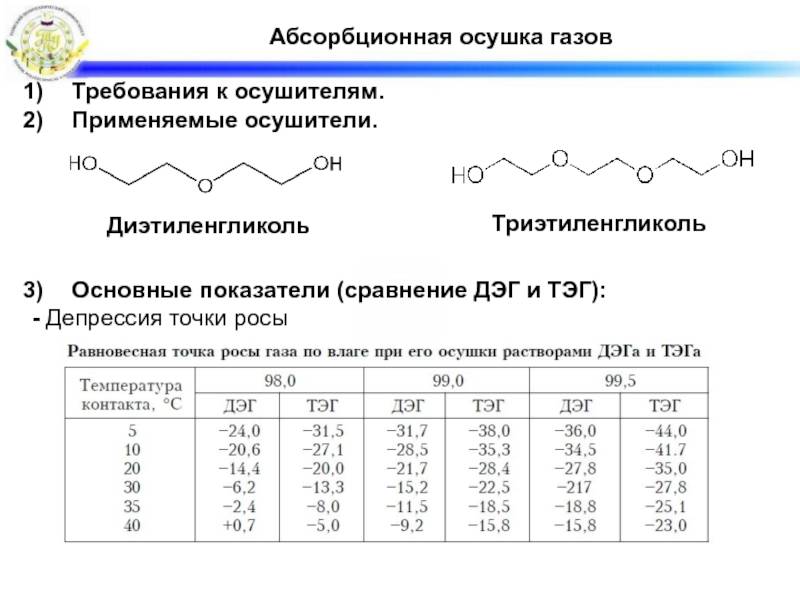
Триэтиленгликоля представляет собой жидкость , вязкая без цвета и запаха.
Он менее токсичен, чем диэтиленгликоль.
Он используется:
- как пластификатор для ПВХ (поливинилхлорид),
- в системах кондиционирования и осушителях воздуха .
- как дезинфицирующее средство в виде аэрозоля .
- как осушающий агент для осушки природного газа .
Что такое этиленгликоль?
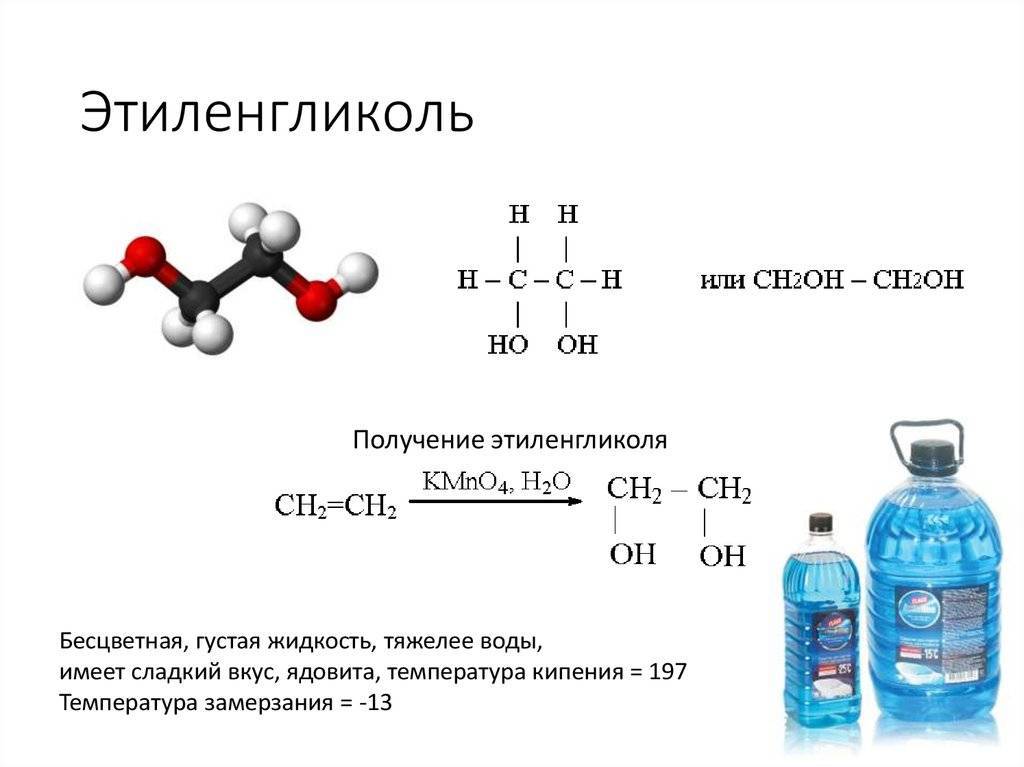
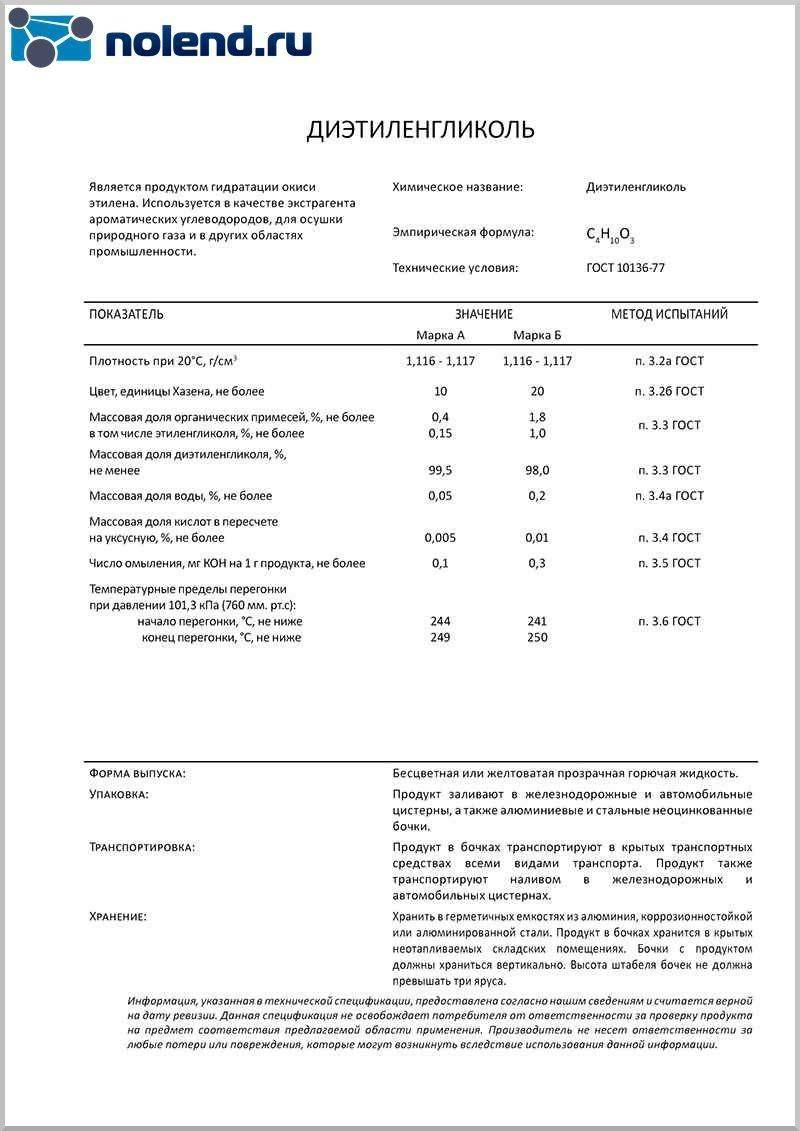
Этиленгликоль – это спирт, имеющий химическую формулу C2ЧАС6О2. Название этого соединения по ИЮПАК: этан-1,2-диол. При комнатной температуре и давлении это бесцветная жидкость без запаха, сладкая на вкус и вязкая. Эта жидкость умеренно токсична. Молярная масса этиленгликоля 62 г / моль. Температура плавления этой жидкости составляет -12,9 ° C, а температура кипения – 197,3 ° C. Этиленгликоль смешивается с водой, поскольку имеет группы -ОН, способные образовывать водородные связи.
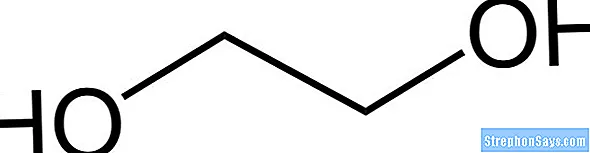
Есть два способа производства этиленгликоля; производство в промышленных масштабах и биологический путь производства этиленгликоля. В промышленном масштабе этиленгликоль получают из этилена. Этилен превращается в оксид этилена, который затем превращается в этиленгликоль посредством реакции между оксидом этилена и водой. Эта реакция катализируется кислотами или основаниями. Если реакция проводится в среде с нейтральным pH, тогда реакционная смесь должна быть снабжена тепловой энергией. Биологический путь производства этиленгликоля заключается в разложении полиэтилена кишечными бактериями гусеницы восковой моли.
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Способы производства дигликоля
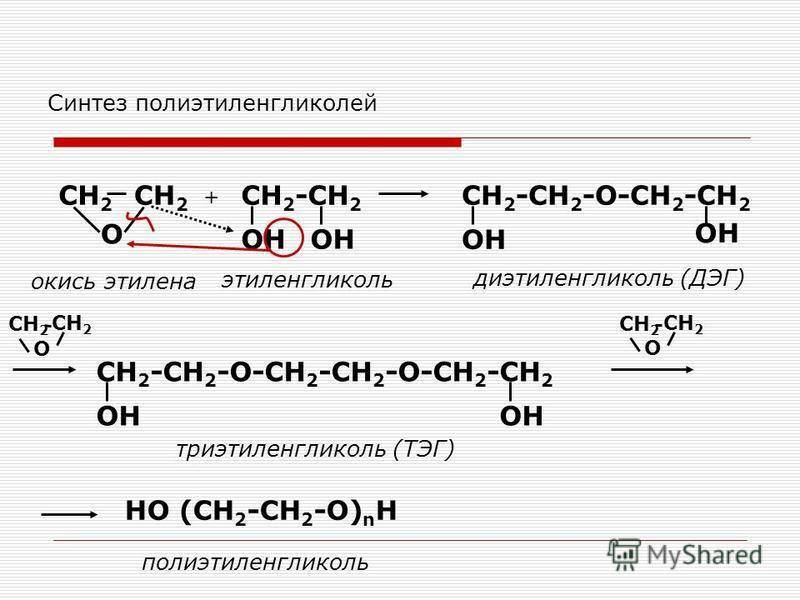
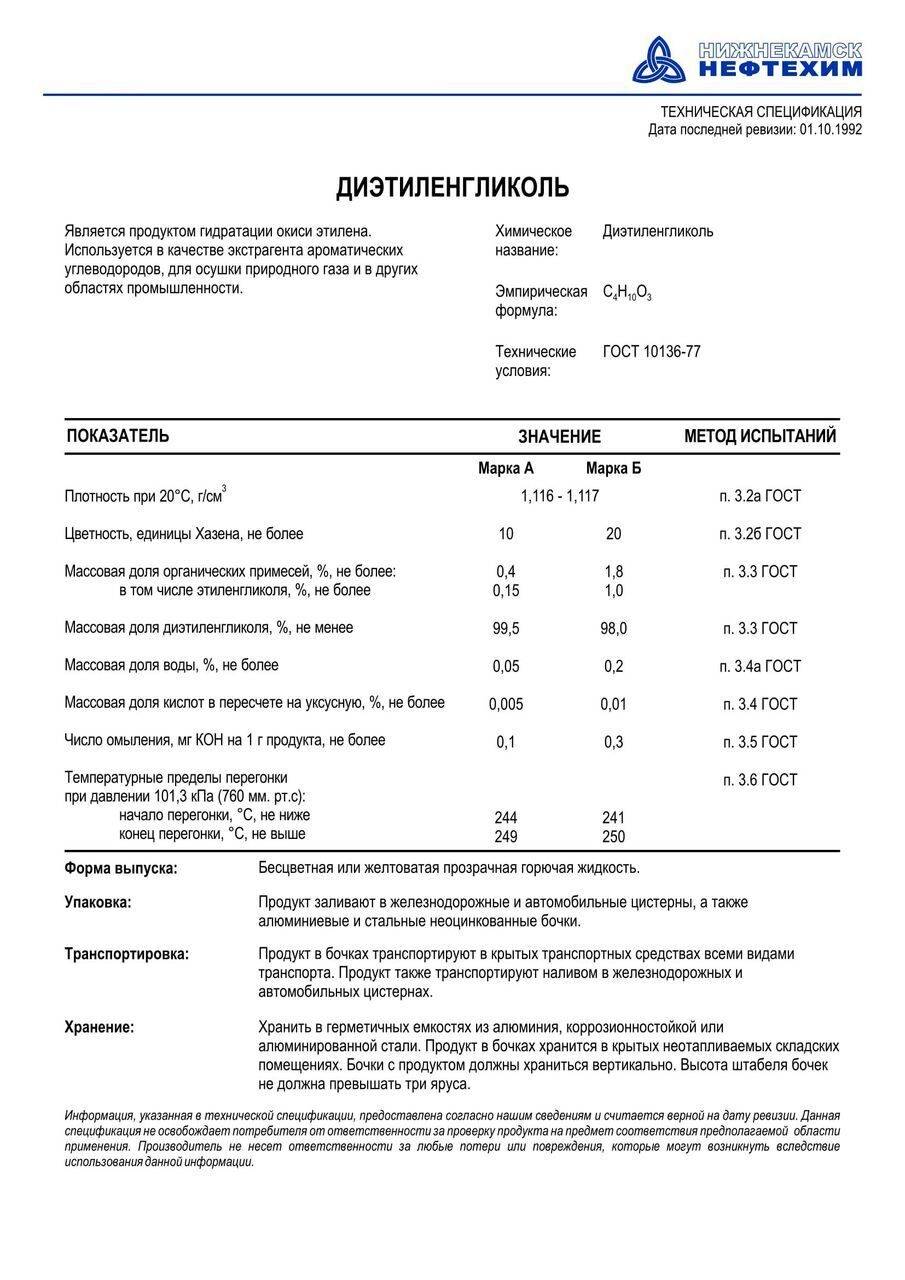
В современной химической промышленность дигликоль получают двумя способами:
- традиционный синтез с моноэтиленгликолем;
- непосредственно из этиленгликоля.
В первом случае используется обычная реакция гидратации окиси этилена. На выходе после синтеза получается моноэтиленгликоль и ДЭГ. После извлечения ДЭГ, оставшийся моноэтиленгликоль можно использовать для синтеза повторно, в том числе в других циклах синтеза органических веществ.
При втором варианте производства ДЭГ проводится несколько этапов реакции окиси этилена и моноэтиленгликоля. В результате получается ДЭГ с минимальным содержанием примесей.
ДЭГ считается умеренно-опасным веществом (3 класс опасности). При попадании внутрь человеческого организма оказывает общее отравляющее действие (особенно выраженное действие на печень и почки). При попадании в воздух пары ДЭГ не оказывают сильного ингаляционного воздействия, так как пары имеют низкую упругость. Обычно концентрация паров ДЭГ в воздухе не оказывает вредного воздействия на человека.
Сфера применения
На практике водные растворы диэтиленгликоля используются в качестве антифриза реже, чем привычная нам моноэтиленгликолевая смесь. Это объясняется не физическими характеристиками вещества (они не различаются столь существенно), а различными объемами производства и доступностью на рынке. Теплоноситель на основе пропиленгликоля или этиленгликоля более доступен, да и стоимость его производства не так высока.
Помимо инженерных систем дигликоль широко используется как селективный растворитель при экстракции нефтепродуктов и ароматических углеводородов – бензола, толуола, ксилола. Он отлично растворяет перечисленные вещества и не оказывает влияние на нафтеновые и парафиновые углеводороды. За счет лучшей растворимости в воде растворитель на основе ДЭГ гораздо эффективнее, что позволяет получать на химическом производстве готовый продукт различной степени чистоты.
Еще одно направление использования – удаление водяного пара из прокачиваемого по трубопроводным системам газа. Решение этой задачи позволяет минимизировать риск образования конденсата и ледяных пробок внутри труб. Кроме того, диэтиленгликоль позволяет эффективно очищать газ от посторонних примесей – диоксида углерода и сероводорода.
Дигликоль незаменим при производстве некоторых полимерных материалов – термостойких и огнестойких полиуретанов, ненасыщенных полиэфирных смол, устойчивых к воздействию щелочи алкидных смол, модифицирующих компонентов. Это синтез активаторов полимеризации, стабилизаторов, пластификаторов, антиоксидантов, отвердителей эпоксидных смол.
Примечания и ссылки
- ↑ and
- ↑ и (ru) Ицхак Маркус, Свойства растворителей , т. 4, Англия, John Wiley & Sons Ltd,1999 г., 239 с. ( ISBN 0-471-98369-1 )
- рассчитывается молекулярная масса от .
- (in) Джеймс Э. Марк, Руководство по физическим свойствам полимеров , Springer,2007 г., 2- е изд. , 1076 с. , стр. 294
- (in) Карл Л. Яс, Справочник по термодинамическим диаграммам , Vol. 1, Хьюстон, Техас, паб Gulf. Co.,1996 г.( ISBN 0-88415-857-8 )
- Rowe.VK, Вольф М.А. Диэтиленгликоль. после Clayton GD, Промышленная гигиена и токсикология Clayton FE Patty, 3-е изд., Том II, Нью-Йорк, Johg Willey & Sons, 1982, стр. 3832-3938.
- Lenk W; и др. Фармакокинетика и биотрансформация диэтиленгликоля и этиленгликоля у крыс. Xenobiotica, 1989, 19, 9 с. 961-979
- Heilmair R. и др. Токсикокинетика диэтиленгликоля (ДЭГ) у крыс. Архив токсикологии , 1993, 67., стр. 655-666
- Мэтьюз. JM и др. Метаболизм и распределение диэтиленгликоля у крыс и док. Распределение метаболизма лекарств, 1991, 19, стр. 1066-1070.
- Токсикологические оценки, 1 Потенциальная опасность для здоровья существующих химикатов Берлин, Springer Verlag, 1990, стр. 217-249
- Weils CC et al. Реакция мочевого пузыря на диэтиленгликоль. Archives of Environmenal Health, 1965, 11, стр. 569-581.
- Hebert JL, Auzepy P, Durand A. Острое человеческое и экспериментальное отравление диэтиленгликолем. Неделя Парижских больниц, 1983, 59, 5, стр. 344-349.
- Моррис Х. Дж. И др. Наблюдение за хронической токсичностью пропиленгликоля, этиленгликоля, диэтиленгликоля, моноэтилового эфира этиленгликоля и моноэтилового эфира диэтиленгликоля. J. Pharmacol. Exp. Ther. , 1942, 74, стр. 266-273
- Lauwerys R & al. Заболевания почек и гематотоксичность из-за воздействия органических растворителей. Скандинавский журнал работы, окружающей среды и здоровья, 1985, 11, супп. 1. С. 83-90.
- Уильямс Дж. И др. Воспроизводимость эффектов диэтиленгликоля и монометилового эфира диэтиленгликоля у мышей Swiqq CD-1, оцененных по протоколу непрерывного разведения. Фундаментальная и прикладная токсикология , 1990, 14, 3 стр. 622-635.
- La Tribune, 02.08.2007, страница 5
Аналоги материала
По входящим в состав компонентам, свойствам и применению есть ряд аналогичных эпоксидных смол из групп ЭД, ТЭГ, КДА. При необходимости ими можно заменить ЭД-20. Ниже приведены самые известные смолы.
ЭД-8
Эпоксидка ЭД-8 производится согласно ГОСТ 10587-84. Она представляет собой растворимый плавкий олигомерный продукт из тех же веществ, что и ЭД-20 (дифенилолпропан и эпихлоргидрин). Смола широко применяется в авиационной, судостроительной, машиностроительной промышленности, при изготовлении лакокрасочных материалов, на стройке, в ремонте техники, электроники. Эпоксидка служит и как связующий компонент для армированного пластика.
По физико-химическим показателям ЭД-8 также мало отличается от ЭД-20. Содержание ионов хлора и омыляемого хлора аналогичное, зато гидроксильные группы в массе не обнаруживаются. Вязкость и температура размягчения такие же. Основное отличие – в массовой доле эпоксидных групп (8%) и времени желатинизации (3 часа).
ЭД-16
Эпоксидная смола ЭД-16 имеет те же свойства и применение, но включает иное число эпоксидных групп – около 16%. Вязкость продукта меньше, чем у ЭД-20, следовательно, желатинизация происходит быстрее (примерно 4 часа). Средство отличается высокими прочностными показателями клеевого шва, но в нем более высокое количество хлора.
ЭД-22
Еще одна эпоксидка на основе эпихлоргидрина и дифенилолпропана, доля эпоксидных групп – 22%. Смола ЭД-22 среди особенностей имеет более высокое время желатинизации – 18 часов, при этом динамическая вязкость составляет 8–12 ПА/секунду.
Э-40
Технология изготовления эпоксидки Э-40 несколько отличается от создания материалов марки ЭД. Продукт получают путем конденсации эпихлоргидрина и дифенилолпропана в щелочной среде с добавлением растворителя толуола. Средство можно переводить в неплавкое состояние путем применения отвердителей – поликарбоновых кислот, их ангидридов, полиаминов.
Сфера применения материала – приготовление эмалей, обладающих высокими защитными свойствами, а также создание лаков и шпаклевок. Кроме того, Э-40 выступает как полуфабрикат для изготовления других эпоксидных смол, клеев и компаундов для заливки. Смола обладает высокой пластичностью, влагостойкостью, в полимеризованном виде не реагирует на действие умеренно агрессивных кислот, щелочей.
Репротоксичность
Из ранних исследований не было обнаружено репротоксического эффекта (у мышей после перорального приема 11,2 г · кг -1 · сут -1 с 6- го по 13- й день беременности или при 5% корме для крыс (через желудочный зонд) или 3 г · кг – 1 · день -1 с 1- го по 20- й день беременности 2 поколений), но в другом исследовании продукт, смешанный с питьевой водой в слаботоксичных дозах для родителей (3,5% или 6,1 г · кг -1 · сутки -1). ) обнаружено влияние на фертильность (уменьшение количества пометов, повышение смертности новорожденных, снижение массы тела при рождении. Никаких различий в влиянии на самцов и самок выявлено не было.
Мошенническое использование
В 1985 году скандал затронул австрийских виноделов , которые добавляли в белое вино диэтиленгликоль , чтобы сделать его более сладким и превратить сухое вино в сладкое , производство последнего было более дорогим, а добавление сахара было легко обнаружить. Количество диэтиленгликоля было слишком низким, чтобы сделать вино токсичным (для этого потребовалось бы около 28 бутылок в день в течение двух недель). Однако встречная реклама привела к значительному сокращению экспорта, что привело к принятию Австрией строгих правил.
В июле-августе 2007 года в связи с очередным скандалом, связанным с токсичными агропродовольственными товарами китайского происхождения в США, присутствие диэтиленгликоля было обнаружено в зубной пасте, произведенной в Китае по поручению компании. Max Brands Marketing BV. Эта зубная паста также была найдена на других западных рынках (Испания, Великобритания, Канада и Франция).
1 – й Августом +2007 во Франции, в результате проведенных проверок в сотрудничестве, то Agence française де sécurité санитарный де Produits де santé (AFSSAPS) и Генеральный директорат по вопросам конкуренции, потребления и пресечения мошенничества (ГУКПБМ) обратил внимание на наличие диэтиленгликоля (ДЭГ) в зубных пастах, продаваемых во Франции под брендом «Toothpaste new 4U». Хотя эти зубные пасты не предназначены для проглатывания, они могут представлять опасность для здоровья при проглатывании у маленьких детей (острая или хроническая интоксикация)
AFSSAPS инициировало процедуру, направленную на производство, маркетинг и бесплатное распространение зубных паст, в состав которых входит DEG.
В 2008 году , в InVS передал предупреждение от (NAFDAC Национального агентства по пищевым продуктам и медикаментам и контроля в Нигерии ), о смерти 25 детей в возрасте от 4 месяцев до 3 -х лет (объявленных 25 ноября 2008 года) в Африке. Следуя использование зубного сиропа («Мой Пикин»), мошенническим образом загрязненного диэтиленгликолем. На 2 декабря 2008 года число погибших составило 39 детей, это число занижено, многие причины смерти в этой стране не выясняются.
Основные области применения ДЭГ
В качестве теплоносителя ДЭГ используют в некоторых сложных инженерных системах. Однако, несмотря на более высокие показатели теплопроводности (в сравнении с пропиленгликолем и этиленгликолем), его нечасто используют в качестве промышленного теплоносителя. На это влияет объем производства и его более высокая стоимость по сравнению с другими распространенными теплоносителями. В основном производимый в стране ДЭГ используется в других областях, в которых оправдывается его более высокая стоимость производства. Более оптимальный и разумный вариант для обеспечения работоспособности инженерных сетей в условиях отрицательных температур – заказать этиленгликоль оптом.
Еще одна область применения ДЭГ — селективный растворитель при экстракции ароматических углеводородов и нефтепродуктов (бензола, толуола, ксилола). В химическом производстве свойства ДЭГ позволяют как увеличить конечный выход продукта, так и значительно улучшить его качество и уровень чистоты.
Свойство ДЭГ улавливать водяные пары из газов активно используется в водяных системах и газопроводах. Это свойство позволяет минимизировать образование ледяных пробок и газового конденсата внутри газопроводных систем. Это же свойство ДЭГ используется для очистки газа от примесей диоксида углерода и сероводорода.
Без дигликоля сегодня не обходится ни одно производство полимерных материалов, таких как:
- производство ненасыщенных полиэфирных смол;
- огнестойкие полиуретаны;
- термостойкие полиуретаны.
С использованием ДЭГ проводится синтез ряда антиоксидантов, отвердителей эпоксидных смол, активаторов полимеризации, ряда стабилизаторов синтеза.
В чем разница между этиленгликолем и диэтиленгликолем?
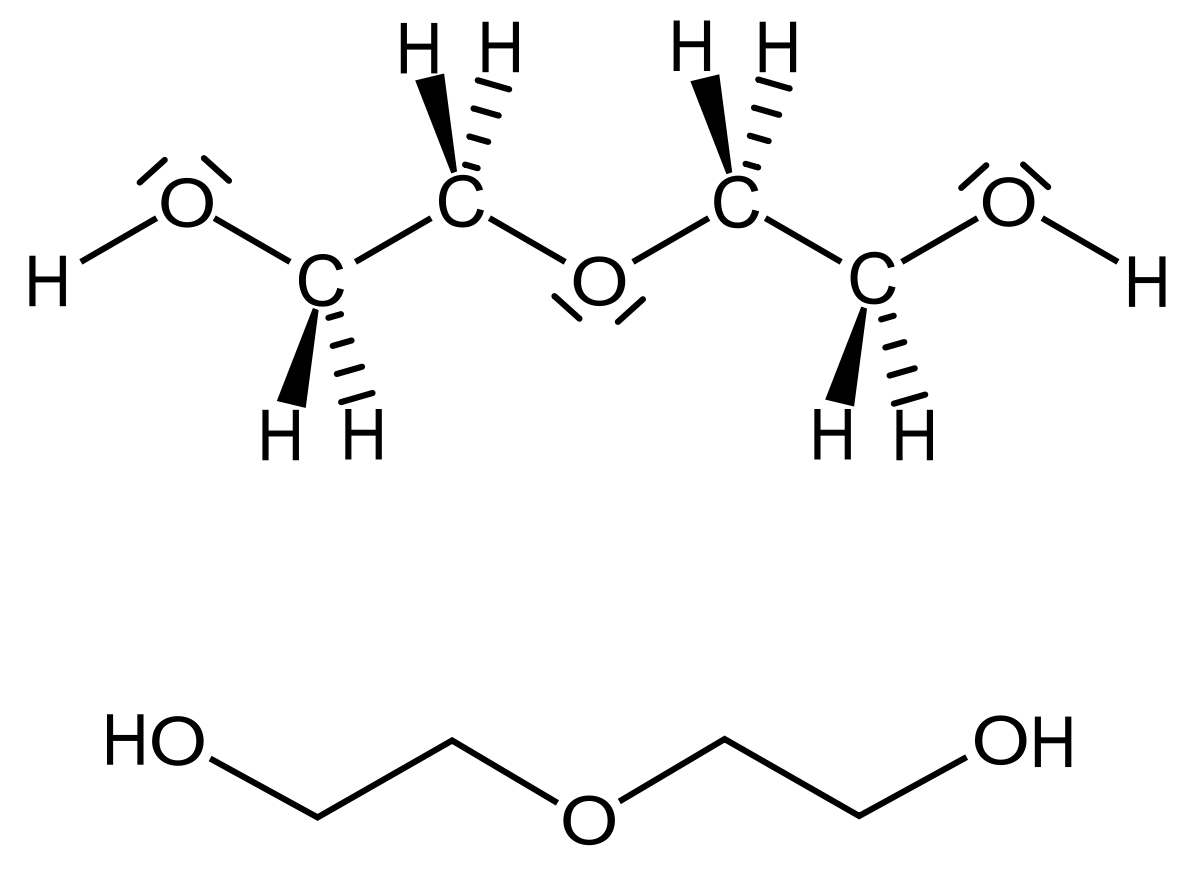
| Этиленгликоль – это спирт, имеющий химическую формулу C2ЧАС6О2. | Диэтиленгликоль – это органическое соединение, имеющее химическую формулу C4ЧАС10О3. |
| Молярная масса | |
| Молярная масса этиленгликоля 62 г / моль. | Молярная масса диэтиленгликоля 106,12 г / моль. |
| Молекулярная структура | |
| Этиленгликоль – это отдельная молекула, производная от окиси этилена. | Диэтиленгликоль представляет собой комбинацию двух молекул этиленгликоля через эфирную связь. |
| Эфирная связь | |
| В этиленгликоле эфирная связь отсутствует. | Эфирная связь связывает две молекулы этиленгликоля. |
| Температура плавления и кипения диэтилена | |
| Температура плавления этиленгликоля составляет -12,9 ° C, а температура кипения составляет 197,3 ° C. | Температура плавления диэтиленгликоля составляет -10,45 ° C, а температура кипения составляет 245 ° C. |
| Производство | |
| Сначала этилен превращается в оксид этилена, который, в свою очередь, превращается в этиленгликоль при взаимодействии с водой. | Диэтиленгликоль получают путем частичного гидролиза этиленоксида. |